23일 업계에 따르면 글로벌 혁신 신약이 1년 안에 한국에 도입되는 비율은 5%다. 경제협력개발기구(OECD) 34개국 중 28위다. 미국제약협회가 2012~2021년 새로 출시된 의약품 460개를 기준으로 한 이 조사에서 한국의 신약 도입률은 리투아니아와 같았다. 슬로바키아(8%) 라트비아(8%) 멕시코(7%) 등은 한국보다 높았다.
한국 환자들은 혁신 신약이 나와도 바로 치료에 쓰지 못한다는 의미다. 신약이 제때 진입하지 못하는 시장 구조는 국내 기업의 기술 개발을 촉진하는 데도 걸림돌이 되고 있다. 국내 바이오기업 대표 A씨는 “미국이나 유럽에서 허가받은 자료를 토대로 허가 여부를 검토하기 때문에 해외 허가 사례가 없다면 국내에서 세계 첫 허가를 받긴 쉽지 않다”고 토로했다.
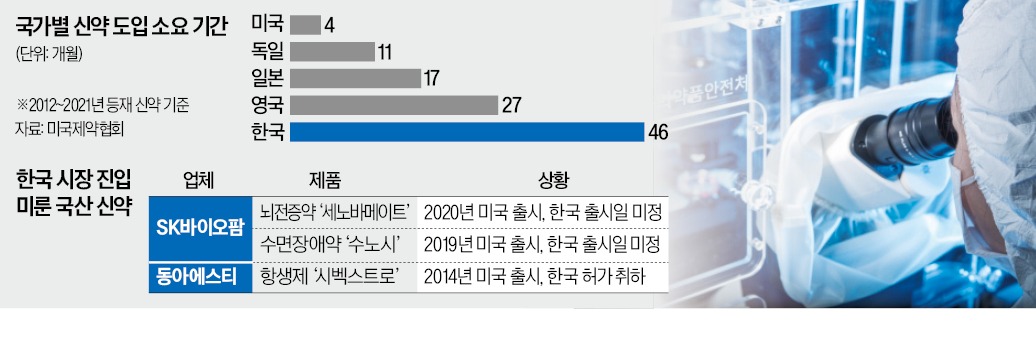
글로벌 혁신 신약이 국내 건강보험 급여 항목에 포함되기까지 평균 3년10개월(46개월)이 걸린다. 미국은 4개월, 일본은 1년5개월(17개월) 만에 포함되는 것을 고려하면 상당히 더디다.
이 과정에서 제약사가 한국 시장을 포기하는 일도 비일비재하다. SK바이오팜은 세노바메이트와 수노시 개발 단계부터 미국 등 글로벌 시장을 겨냥했다. 한국에 먼저 출시하면 약값이 낮아지는데 다른 국가에서 이를 근거로 낮은 약가를 요구할 우려가 컸기 때문이다. 시벡스트로는 24번째 국산 신약으로 2015년 식품의약품안전처 허가를 받고도 약가 협상에 실패해 2020년 국내 허가가 철회됐다. 건강보험당국은 당시 미국(312달러)의 3분의 1 수준인 13만원을 약값으로 책정한 것으로 알려졌다.
국내 제약사들은 복제약(제네릭)과 개량신약도 약가 인하 압박이 크다고 토로한다. 최윤희 법무법인 태평양 전문위원은 “제네릭과 개량신약 개발로 축적된 경험과 지식은 한국이 제약·바이오 강국으로 도약하는 핵심 기반이 된다”며 “이들 의약품의 가치를 인정하는 제도를 설계해야 한다”고 했다.
이지현 기자 bluesky@hankyung.com
관련뉴스













