▶본지 6월 12일자 A1, 8면 참조
식품의약품안전처는 엑스코프리의 품목허가를 냈다고 3일 밝혔다. 부분발작이 있는 성인 뇌전증 환자를 치료하는 데 사용된다. 기존 항뇌전증약으로 증상 조절이 되지 않는 환자에게만 처방이 가능하다. 뇌전증은 뇌세포가 일시적인 이상을 보여 신체의 일부 또는 전체가 의지대로 움직이지 않고 발작을 보이거나 의식을 잃게 되는 질환이다.
엑스코프리는 SK바이오팜이 자체 개발한 뇌전증 치료제로, 뇌에 흥분성 신호를 전달하는 나트륨 채널을 차단해 신경세포의 흥분성 및 억제성 신호의 균형을 정상화한다. 다른 항경련제와 달리 이중 작용기전을 통해 신경세포 신경전달을 정상적으로 조절해 약효가 뛰어나다. 다국가 임상을 통해 투약군의 21%가 발작이 완전 소실되는 등 뛰어난 효과를 입증했다. 기존 글로벌 블록버스터 약물인 ‘빔팻’의 발작 완전소실 효과(4.8%)보다 뛰어난 수준이다.
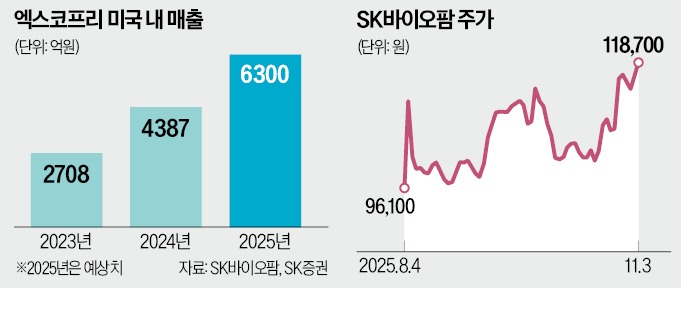
엑스코프리는 2019년 11월 미국 식품의약국(FDA)에서 허가받은 후 2021년 1월 유럽의약품청(EMA)의 허가를 받아 현재 글로벌 주요 시장 25개국에서 판매되고 있다.
SK증권에 따르면 엑스코프리의 미국 내 월별 처방 건수(TRx)는 2022년 1월 1만518건에서 올해 1월 3만4606건으로 크게 늘었다. 총 누적 처방 환자는 14만 명을 넘어섰다. 세계 매출도 2023년 2708억원에서 2024년 4387억원으로 62% 증가했다. 다만 국내 시장에서는 진출이 늦어졌다. 한국은 신약에도 낮은 약가를 유지하고 있어 수익성이 매우 낮기 때문이다. 이에 관련 학회, 환자 단체 등에서 엑스코프리의 국내 도입을 촉구하는 목소리가 높아졌고, 지난 2월 품목허가 신청을 내게 됐다. SK바이오팜은 엑스코프리의 적응 대상을 성인에서 청소년과 소아로, 적응증은 부분발작에서 전신발작으로 점차 확대해나갈 전망이다.
엑스코프리는 식약처가 신속한 신약 허가를 위해 올해 제정한 ‘신약 품목허가·심사 업무절차’ 지침을 적용해 허가하는 첫 품목이다. 엑스코프리의 국내 판권은 동아에스티가 보유하고 있다. 동아에스티는 2024년 1월 SK바이오팜으로부터 한국을 포함해 30개국에 대한 허가 획득, 제품 판매, 완제의약품 생산 권리를 이전받았다. 동아에스티는 연내 급여등재 신청을 마무리한 뒤 2027년 상반기 엑스코프리를 출시할 계획이다.
동아에스티 관계자는 “뇌전증 환자의 약 30%는 기존 약물로 증상이 조절되지 않는 약물난치성 뇌전증 환자”라며 “엑스코프리의 보험 약가 신청 및 등재를 신속히 추진해 국내 뇌전증 환자가 빠르게 치료 혜택을 받을 수 있도록 최선을 다하겠다”고 말했다.
SK바이오팜은 새로운 글로벌 신약 개발에 도전한다. 회사는 이날 미국 바이오텍 인테론과 자폐스펙트럼장애(ASD) 치료제 후보물질 공동 연구개발 계약을 체결했다고 밝혔다. 양사는 이번 계약을 통해 세계 첫 ASD 치료제의 후보물질을 개발할 계획이다. SK바이오팜은 엑스코프리를 개발하면서 축적한 기술력을 바탕으로 개방형 혁신을 이끌 예정이다.
오현아 기자 5hyun@hankyung.com
관련뉴스













