16개 품목 국내승인…국내검사용 현재까지 359만명분 생산, 212만건 검사

(서울=연합뉴스) 계승현 기자 = 식품의약품안전처는 국내 업체들이 지난달까지 신종 코로나바이러스 감염증(코로나19) 진단시약 총 1억9천13만명분을 약 150개 국가에 수출했다고 15일 밝혔다.
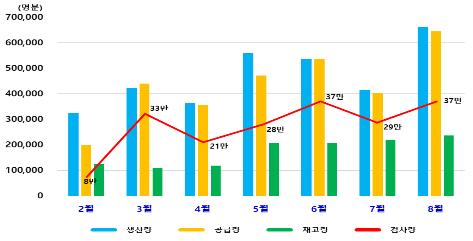
국내 업체들은 지난 4월 3천464만명분을 수출한 이후 8월까지 매월 3천만명분 이상을 전 세계로 수출하고 있다고 식약처는 설명했다.
수출용 진단 시약은 총 166개 제품이 허가받았으며, 이 중 16개 제품이 미국 식품의약국(FDA) 긴급사용승인(EUA) 제품으로 등록됐다.
국내 검사용 진단시약은 지금까지 359만명분을 생산해 이 중 329만명분이 공급됐으며, 지금까지 총 212만건의 검사에 쓰였다.
현재 확보된 국내 재고 약 30만명분은 최근 일주일 동안 1일 평균 검사량 1만5천명분을 고려했을 때 약 20일간 의료현장에 공급할 수 있는 물량이라고 식약처는 말했다.
국내에서 코로나19 진단을 위해 사용할 수 있는 제품은 총 16개다.
확진 검사용 긴급사용승인 제품 7개, 응급 선별용 긴급사용승인 제품 9개, 정식허가 제품 총 1개다. 에스디바이오센서의 확진 검사용 제품은 지난 2월 긴급사용승인을 받은 데 이어 지난 8월 정식허가를 받았다.
국내 사용 중인 코로나19 진단시약은 실시간 유전자 증폭검사(RT-PCR) 방식으로, 사용 목적에 따라 '확진 검사용'과 '응급 선별검사용'으로 구분된다.
확진 검사제품은 코로나19 감염자의 확진을 목적으로, 6시간 이내 결과를 확인해 진단할 수 있다.
응급선별검사 제품은 1시간 이내 결과를 확인할 수 있는 제품으로, 긴급 수술이 필요한 환자 등 중증 응급환자를 대상으로 빠르게 코로나19 음성을 확인하는 목적으로 사용된다. 다만 검사 결과 양성인 경우 확진 검사제품으로 재검사해 확진 여부를 판단하고 있다.
이 외에도 RT-PCR 및 면역검사(항원·항체검사) 등 총 18개의 코로나19 진단시약 제품이 임상적 성능시험을 거쳐 정식허가를 신청했다. 임상적 성능시험계획 승인을 받은 14개 제품은 성능시험 중에 있다.
코로나19와 독감(인플루엔자) 동시 진단시약은 1개 제품이 임상적 성능시험 절차를 밟고 있으며 10월까지는 식약처의 정식허가를 받을 것으로 예상된다.
key@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스













