"이식환자에 미칠 위험성 낮지만, 모니터링 필요"
"환자 대응 요령 전달 예정…이상 사례 발생 시 의료기관 방문해야"
(서울=연합뉴스) 계승현 기자 = 식품의약품안전처는 13일 의료기기 업체 한스바이오메드가 허가사항과 다른 원료를 사용해 만든 실리콘 겔 인공유방 '벨라젤' 품목을 회수하도록 조처했다고 밝혔다.
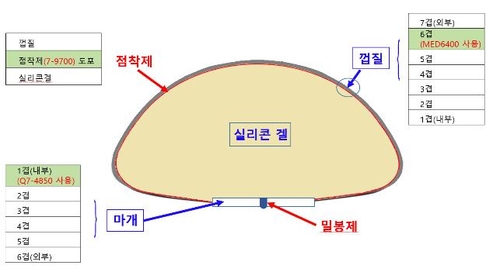
실리콘 겔 인공유방은 유방을 재건하거나 성형하는 데 사용되는 제품으로, 실리콘 주머니 안에 실리콘 겔이 포함된 형태다.
식약처는 한스바이오메드 점검 결과 지난 2015년 12월부터 허가사항과 다른 원료를 사용해 부적합한 인공유방을 생산하고, 약 7만여개를 의료기관에 공급한 사실을 확인했다.
허가사항에 기재되지 않은 원료는 총 5종으로, 이중 실리콘 점착제는 피부접촉 의료기기인 상처보호제에, 나머지 4종은 국내 허가된 인공유방, 심장판막 등 다른 인체 이식 의료기기에 사용되는 원료다.
식약처는 전문가 자문회의를 거쳐 이 원료들은 정상적 상태에서 누출 가능성이 매우 적어 이식환자에 미칠 위험성은 낮다고 판단했다. 그러나 이식환자에 대한 지속적인 모니터링은 필요하다고 봤다.
인공유방 제조공정 중 고온 환경에서 발생 가능하다고 알려진 기체 '포름알데히드'는 이후 내부 공기 제거 과정을 거쳐 제품에는 잔류 가능성이 적다고 전문가들은 의견을 제시했다.
식약처의 완제품 포름알데히드 잔류시험 결과 이 제품에서는 검출되지 않았다.
식약처는 해당 품목에 대한 판매 중지와 회수를 명령하고 성형학회, 대한의사협회 등 관련 단체를 통해 의료기관에 해당 제품의 사용을 중지하도록 요청했다. 한스바이오메드에는 의료기기법 위반으로 업무정지 등 행정처분을 할 예정이다.
식약처는 건강보험심사평가원을 통해 해당 제품을 이용해 유방재건술을 실시한 환자 현황을 파악하고 있다. 또 의료기관별 제품공급내용을 기반으로 전체 이식환자 정보 등을 파악 중이다.
식약처는 "개별 이식환자에게 정기검사 항목, 진단 절차, 환자 대처요령 등 정보를 의료기관을 통해 제공할 예정"이라면서 "다만 시술 부위에 통증이 있거나 제품 파열 등 이상 사례가 발생할 시 즉시 시술의료기관의 전문가와 상담하라"고 당부했다.
식약처는 한스바이오메드에 이식환자 보상방안을 마련해 제출하도록 했고, 진단 및 검사비, 부작용 시 보상대상·범위·기간을 이른 시일 내에 확정하도록 할 예정이다.
여러 분야의 전문가와 논의해 환자 장기 모니터링 등 계획을 수립하고 그 결과를 평가할 예정이다.
key@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스













