식약처 "국내승인 치료제·백신 임상시험 28건…7건 완료"
(서울=연합뉴스) 계승현 기자 = 식품의약품안전처는 국내에서 승인받은 신종 코로나바이러스 감염증(코로나19) 치료제와 백신 임상시험은 총 28건이라고 10일 밝혔다. 치료제 26건, 백신 2건이다.
이중 치료제 임상 7건이 종료됐다. 현재 진행 중인 임상은 치료제 19건, 백신 2건으로 총 21건이다. 제약사 임상은 18건, 연구자 임상은 3건이다.
신규 승인된 2건의 치료제 임상시험은 한국MSD의 'MK-4482' 임상 2/3상, 뉴젠테라퓨틱스의 '뉴젠나파모스타트정' 임상 1상이다.
MK-4482 임상시험은 독감 치료제로 개발 중인 신약을 코로나19 치료제로 개발하는 약물 재창출 시험이다. 글로벌 임상으로 진행되고 있다.
나파모스타트정은 현재 항응고제로 사용되는 나파모스타트메실산염 성분 주사제를 먹을 수 있는 정제로 개발해 복용 편의성을 개선한 제품이다.
국내에서 개발 단계에 있는 치료제로는 부광약품[003000]·신풍제약[019170]·대웅제약[069620] 등의 항바이러스제, 셀트리온[068270] 중화항체 치료제, GC녹십자 혈장 치료제, 엔지켐생명과학[183490] 면역조절제 등이다.
백신으로는 제넥신[095700] DNA 백신이 임상 중이다.
대체 치료 수단이 없는 환자에 치료 기회를 제공하기 위해 GC녹십자 혈장 치료제의 치료목적 사용이 3건 승인됐다.
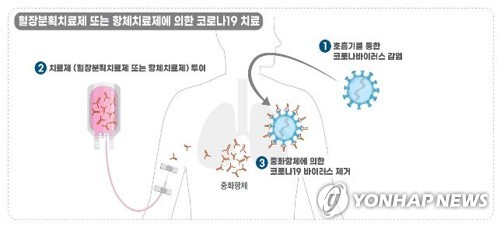
치료제 중 개발 속도가 빠른 분야는 항체치료제다. 셀트리온은 항체치료제 'CT-P59'의 코로나19 경증 및 중등증 환자 대상 글로벌 임상 2/3상을 하고 있다.
해외에서도 미국 '일라이릴리'(이하 릴리)와 '리제네론'이 항체치료제로 경증 및 중등증 환자 대상 임상 2/3상을 하고 있다.
두 제품 모두 미국 식품의약국(FDA)에 긴급사용승인(EUA)을 신청했고, 릴리의 제품이 이달 9일 승인받았다.
릴리의 임상 2상 중간시험 결과 발표에 따르면 대조군 대비 시험군에서 증상 악화로 입원하는 비율이 감소했고, 안전성 우려는 없었다.
다만 별개로 진행 중인 중증환자 대상 임상 3상에서는 치료효과가 부족한 것으로 나타나 지난달 26일 조기 종료됐다.
리제네론의 중증환자 대상 임상 3상은 '독립적 데이터 모니터링 위원회'의 권고에 따라 추가적인 안전성 평가를 위해 심각한 중증환자 등록을 중단했다.
key@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>
관련뉴스













