지난 주요뉴스 한국경제TV에서 선정한 지난 주요뉴스 뉴스썸 한국경제TV 웹사이트에서 접속자들이 많이 본 뉴스 한국경제TV 기사만 onoff
-
에어부산 항공기, 김해공항서 이륙 직후 조류충돌로 회항 2025-05-02 16:26:42
부산 김해국제공항에서 출발한 에어부산 항공기가 이륙 직후 새와 충돌해 긴급 회항하는 일이 발생했다. 2일 에어부산에 따르면 전날 오후 7시 19분께 김해공항에서 출발해 말레이시아 코타키나발루로 향하던 에어부산 BX761편이 이륙한 뒤 새와 부딪혔다. 당시 항공기에는 승객 176명이 타고 있었다. 항공기는 연료를...
- 뉴스 > 사회
- 바로가기

-
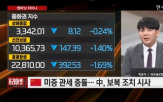
트럼프 ‘상호관세’ 발표에 잘 버티는 中증시...본격 부양책 시행 국면 2025-04-04 14:17:52
▲항서제약을 언급했다. 박 파트너는 “항서제약은 과거 HLB와 임상 협업을 진행한 바 있는 중국 바이오 기업으로, 최근 관세 불확실성 속에서도 주가 반등이 이어지고 있다”며 “미국과 중국 간 관계 악화로 위탁생산(CMO) 수요가 유럽으로 이동할 가능성이 커지는 가운데 유럽과의 협력 가능성이 있는 기업들이 주목받고...
- 뉴스 > 증권
- 바로가기
-
HLB 정기주총 개최…"반드시 간암 신약 허가받겠다" 2025-03-31 15:14:20
회장은 "파트너사인 항서제약이 보완요구서한(CRL)을 수령한 다음날, FDA에 구체적인 미비사항을 확인할 수 있는 '포스트 액션 레터(PAL)'를 요청했고, 이를 미국 자회사인 엘레바에 공유하는 등 양사가 긴밀히 소통하며 신속히 대응하고 있다"면서 "보완사항을 조속히 파악해 허가를 재신청하고 가능한 한 빠르게...
- 뉴스 > IT·과학
- 바로가기

-
진양곤 "FDA 승인 자신...주식 한 주도 안 팔 것" 2025-03-31 15:00:11
이번주 중 파트너사인 항서제약으로부터 FDA가 발행한 공식 문서 PAL(Post Action Letter)를 받을 예정이며, 이를 통해 문제 상황을 정확하게 확인하겠다고 밝혔습니다. 많은 신약이 CRL 수령 후 허가를 받은 전례가 있어, 문제 상황 보완 후 5월 중 세 번째 허가를 신청해 이르면 7월 결과를 받는다는 계획입니다. 직접...
- 뉴스 > 산업.IT
- 바로가기

-
진양곤 HLB 회장, 간암 신약 FDA 재도전 의사 밝혀 2025-03-31 14:30:23
- 중국 항서제약과 공동 개발 중인 해당 신약은 이달 FDA로부터 두 번째 보류 판정을 받아 투자자들의 우려를 자아내고 있음. - 이에 진 회장은 신약 승인 전 주식 매도 없음을 강조함. - 주총에서는 FDA 승인 불발에 대한 주주들의 문의가 있었으며, HLB는 곧 항서제약으로부터 FDA가 발행한 공식 문서 '포스트 액션...
- 뉴스 > 증권
- 바로가기
-
'FDA허가 2차 불발' HLB "승인 재도전…간암신약 약효 문제없어" 2025-03-31 11:33:40
건은 철회했다. 앞서 2023년 HLB는 리보세라닙과 중국 항서제약 면역항암제 '캄렐리주맙'의 병용요법에 대해 FDA에 간암 1차 치료제로 신약 허가를 신청했으나, 지난해 항서제약이 FDA로부터 CRL을 받으면서 승인이 불발됐고, 2차 신청에 대해서도 멸균 절차 등을 지적받으며 이번 달 승인이 재차 무산됐다. 한...
- 뉴스 > 경제
- 바로가기

-
조종사 착각에…진에어, 김해공항서 엉뚱한 활주로 착륙 2025-03-26 15:57:11
김해공항에서 진에어 여객기가 허가받지 않은 활주로로 착륙하는 일이 발생해 국토교통부가 조사에 나섰다. 26일 진에어 등에 따르면 전날 오후 5시 35분쯤 삿포로에서 출발한 진에어 LJ312가 김해공항 '18L'(왼쪽) 활주로에 착륙했다. 이 여객기는 오른쪽에 있는 '18R' 활주로에 착륙을 허가받은...
- 뉴스 > 산업
- 바로가기

-
FDA 승인 재도전에 HLB그룹주 반등 2025-03-24 17:25:45
일제히 반등했다. HLB는 FDA에서 표적항암제 리보세라닙과 항서제약 면역항암제 캄렐리주맙의 병용 요법에 관한 간암 1차 치료제 심사 결과 보완요구서한(CRL)을 수령했다고 지난 21일 밝혔다. 2023년 FDA에 간암 1차 치료제 신약 허가를 신청했지만 지난해 5월 항서제약이 CRL을 받았고, 두 번째 신청에서도 승인이 불발됐...
- 뉴스 > 증권
- 바로가기
-
롤러코스터 타는 HLB그룹株…"간암 신약 5월 재도전"에 급반등 2025-03-24 14:19:31
식품의약국(FDA)으로부터 표적항암제 리보세라닙과 항서제약의 면역항암제 캄렐리주맙의 병용 요법에 대한 간암 1차 치료제 심사 결과 보완요구서한(CRL)을 수령했다고 밝혔다. 2023년 FDA에 간암 1차 치료제 신약 허가를 신청했으나 지난해 5월 항서제약이 보완요구서를 받았고, 두 번째 신청에서도 승인이 불발됐다. HLB...
- 뉴스 > 증권
- 바로가기
-
FDA 승인 실패에도 반등한 HLB…유한양행 학회 앞두고 주목 2025-03-24 11:03:34
달리 중국 항서제약 측에 문제가 있었음이 밝혀졌기 때문임. 그러나 아직 불확실성이 존재하므로 신규 접근은 유의해야 함. - 4월 2일에 예정된 상호관세 부과 여부가 확정되지 않아 시장의 변동성이 커지고 있음. 자동차, 반도체, 제약 등 산업별 관세는 발표 대상에서 제외될 가능성이 있다는 외신 보도가 전해짐. -...
- 뉴스 > 증권
- 바로가기






